⇧ [VIDÉO] Vous pourriez également aimer ce contenu partenaire
À l’aide d’une version améliorée d’AlphaFold, un outil d’IA de prédiction de la structure des protéines développé par Google DeepMind, les chercheurs ont identifié un complexe de trois protéines clés essentielles à la reconnaissance des œufs et des spermatozoïdes. Ce trimère serait commun à tous les vertébrés et son absence entraîne inévitablement un échec de fécondation. Cette découverte contredit l’hypothèse de longue date selon laquelle deux protéines, situées respectivement sur les deux gamètes mâle et femelle, suffisent à assurer la fécondation.
La vie de tout organisme sexuel commence par la fécondation, à savoir la fusion d’un spermatozoïde avec un ovule. Le gamète mâle se déplace vers l’ovule guidé par des signaux chimiques, puis se lie à la surface de l’œuf grâce à des interactions protéiques spécifiques. Cette interaction permet à leurs membranes de fusionner, déclenchant alors la fusion de leur matériel génétique pour former un zygote, la cellule unique qui se développe en embryon.
Cependant, malgré les progrès de l’imagerie, les mécanismes moléculaires régissant cette interaction restent en partie mystérieux. En effet, contrairement à la plupart des cellules des organismes sexuels qui évitent la fusion et maintiennent une identité génétique distincte, le sperme et l’ovule sont spécialisés pour la fusion. Cela implique une séquence d’événements moléculaires précis et hautement spécifiques, se déroulant principalement au niveau de leurs membranes lipidiques. Ces processus sont à la fois discrets et éphémères, ce qui les rend difficiles à étudier avec des techniques biochimiques standards.
En revanche, la collecte et le stockage d’ovules et de spermatozoïdes viables chez certains animaux de laboratoire, comme les souris, sont particulièrement complexes. La plupart des études en biologie de la reproduction se sont donc concentrées principalement sur les invertébrés marins (comme les oursins), car ils peuvent libérer de grandes quantités d’œufs et de spermatozoïdes viables dans l’eau.
Pour surmonter ces défis, les chercheurs de la nouvelle étude ont concentré leurs travaux sur le poisson zèbre (Danemark rerio), un vertébré qui libère ses ovules (ou œufs) et ses spermatozoïdes dans l’eau. Ils se sont également appuyés sur le pouvoir prédictif d’AlphaFold, qui a remporté cette année le prix Nobel de chimie pour deux de ses développeurs, pour déterminer à l’avance les interactions possibles entre les protéines membranaires des gamètes.
L’IA a permis de découvrir une protéine essentielle jusqu’alors non identifiée. ” Ce n’est plus le vieux concept d’avoir une clé et une serrure pour ouvrir la porte, c’est plus compliqué », explique à la revue Nature Enrica Bianchi de l’Université de Rome Tor Vergata, qui n’a pas participé à l’étude.
Résumé graphique de l’étude. © Victoria E. Deneke et al.
Une protéine spermatique supplémentaire identifiée
Au cours des 20 dernières années, le dépistage génétique a permis d’identifier plusieurs protéines essentielles à l’interaction entre les gamètes mâles et femelles des organismes sexuels. Izumo1 est présent au niveau de la membrane du spermatozoïde et se lie à Juno, présent à la surface de l’ovule lors de la fécondation. D’autres protéines structurellement similaires à Izumo1 (Spaca6 et Tmem95) sont présentes au niveau de la membrane du sperme, mais ne semblent pas se lier à Juno, selon des expériences de laboratoire antérieures.
En concentrant leur analyse sur les protéines de liaison aux spermatozoïdes, la nouvelle équipe d’étude a utilisé AlphaFold Multimer, une version améliorée d’AlphaFold, pour identifier d’autres protéines de liaison potentielles. ” Nous avons collecté une liste de protéines susceptibles d’être présentes au niveau de la membrane du sperme et effectué un examen bioinformatique incluant des milliers de prédictions à l’aide d’AlphaFold Multimer. », explique dans un communiqué de l’Institut de recherche en pathologie moléculaire (IMP), Victoria Deneke, co-auteure principale de l’étude.
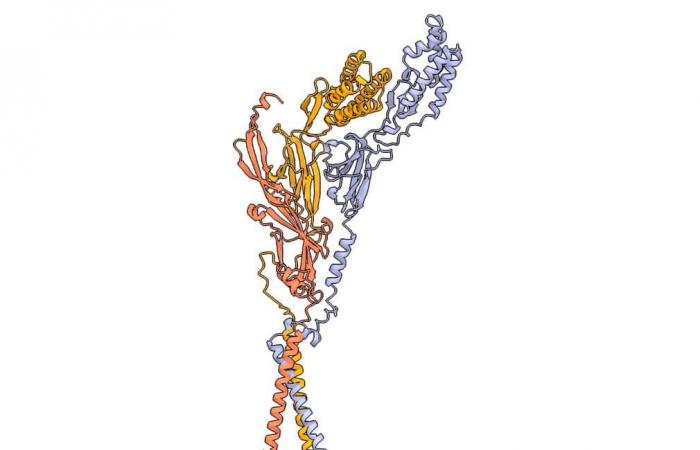
L’algorithme a identifié Tmem81, une autre protéine jusqu’alors inconnue, considérée comme essentielle à la liaison de Juno. Plus précisément, Izumo1 et Spaca6 interagissent non seulement entre eux, mais également avec Tmem81 avant de pouvoir se lier à la protéine de l’œuf. Ces premiers résultats démontrent l’importance des algorithmes de prédiction et de modélisation dans les cas de possibilités de démonstration empirique limitées.

Le complexe spermatique trimérique composé d’Izumo1 (jaune), Spaca6 (lavande) et Tmem81 (rouge). © Victoria E. Deneke et al.
Un complexe conservé au cours de l’évolution des vertébrés
Pour tester ces prédictions, les chercheurs ont observé les processus moléculaires de fécondation d’abord chez le poisson zèbre, puis chez la souris et dans des cellules humaines isolées. Ils ont constaté que le trimère est effectivement essentiel à la fécondation dans tous les modèles.
Le complexe de trois protéines est ancré à la membrane du spermatozoïde, tandis que deux d’entre elles constituent un site de liaison permettant au spermatozoïde de s’arrimer à l’ovule via Juno pour les mammifères, et via une protéine équivalente appelée Bouncer chez les mammifères. Poissons. En d’autres termes, Juno et Bouncer servent de verrou d’accès à l’œuf et n’autorisent cet accès qu’avec la bonne « clé ». De plus, sans interaction trimère, le gamète mâle est stérile et la fécondation échoue.
Voir aussi

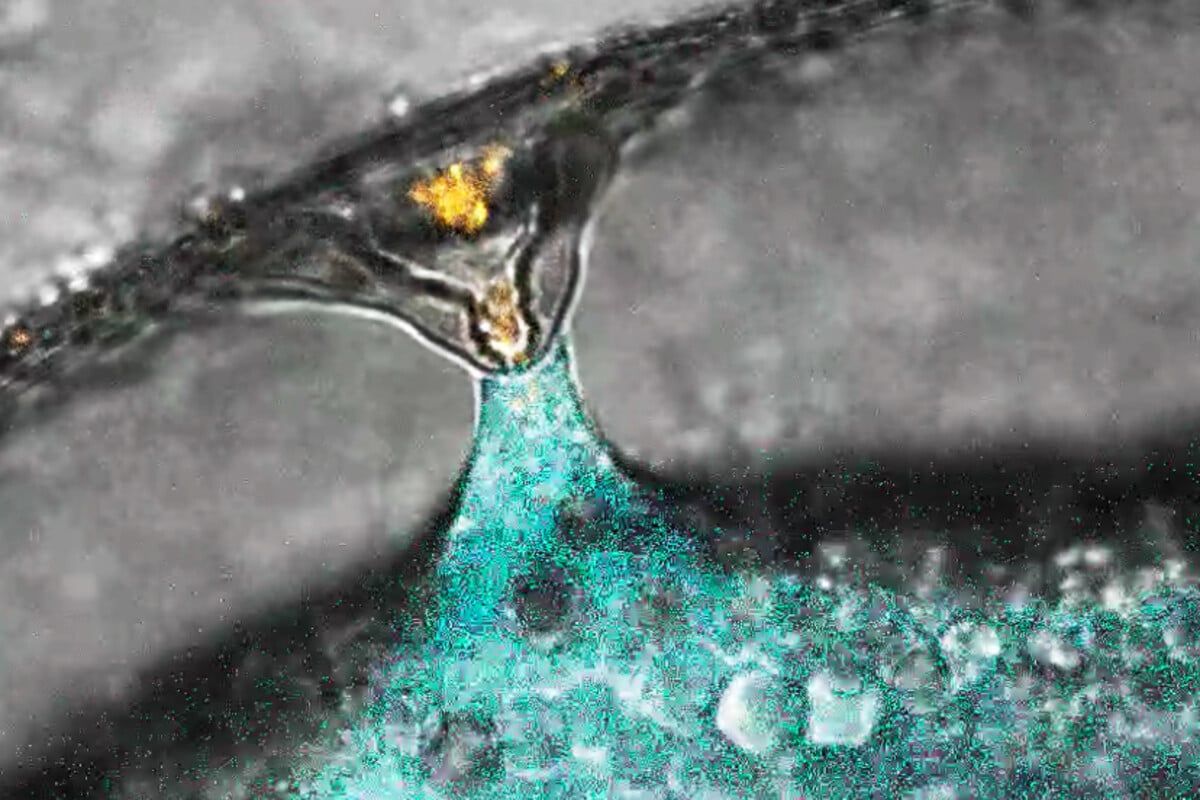

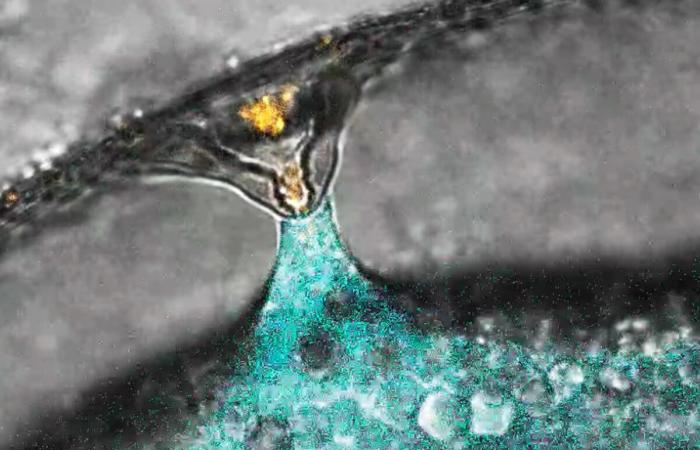
Fécondation d’un œuf de poisson zèbre (marqué en bleu) par un spermatozoïde (marqué en orange). © IMP
Ces résultats suggèrent que contrairement aux protéines de l’œuf, le complexe spermatique Izumo1-Spaca6-Tmem81 est commun à tous les vertébrés et a été conservé tout au long de leur évolution. Juno est par exemple issue de la duplication d’un récepteur fœtal spécifique aux mammifères et n’est donc présente que chez ces derniers. ” Le fait qu’il ait été maintenu pendant des millions d’années d’évolution montre à quel point ce processus de verrouillage et de clé est important, mais ce qui est vraiment surprenant, c’est que le trimère du sperme conservé utilise des protéines d’ovules sans rapport avec l’évolution pour se fixer à la surface de l’ovule. », explique Andrea Pauli de l’IMP, également co-auteur de l’étude.
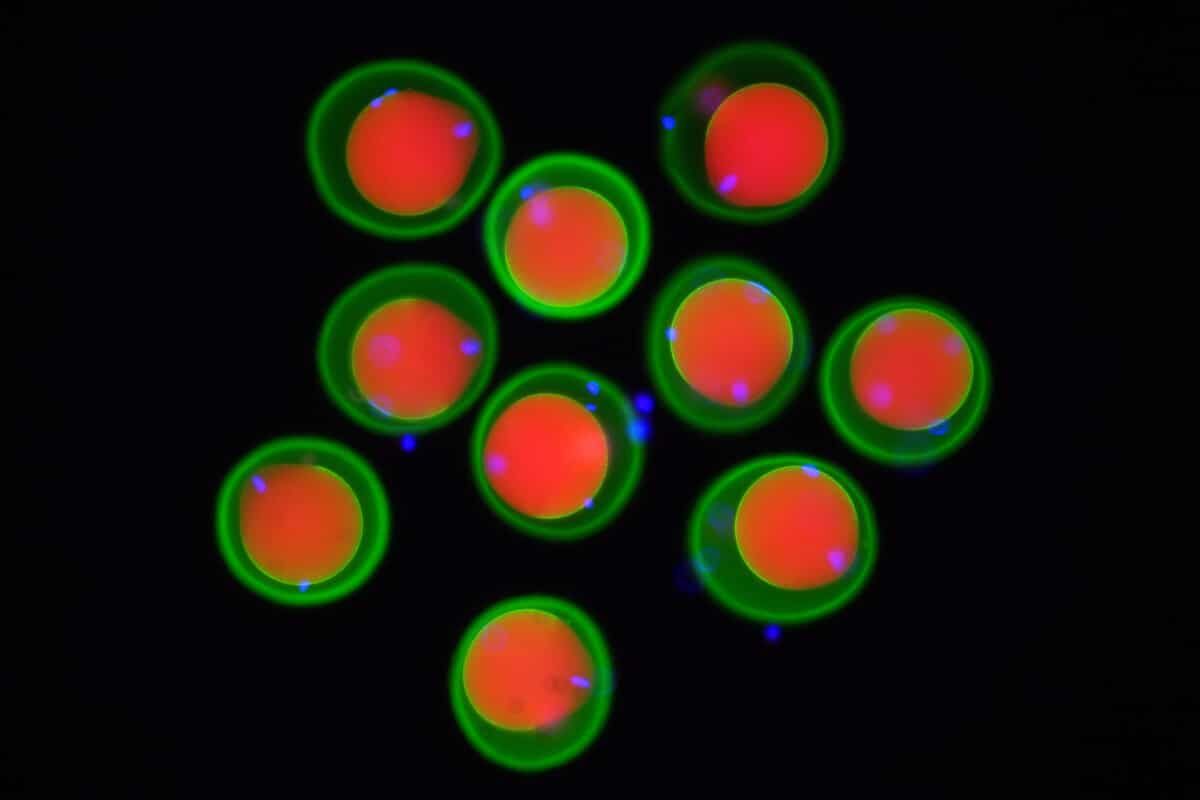

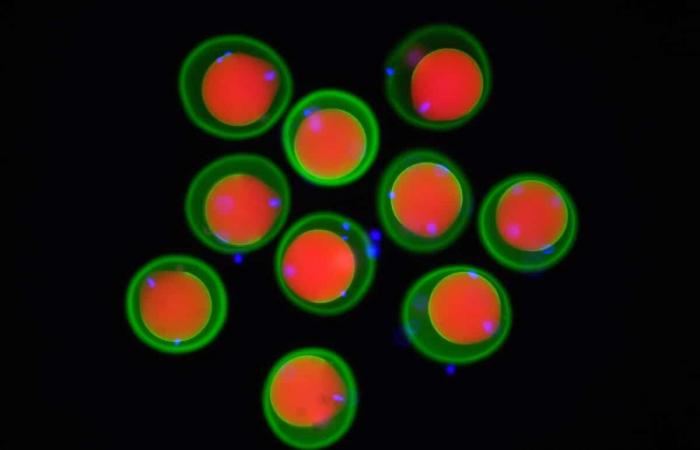
Image d’œufs de souris (marqués en rouge et vert) et de spermatozoïdes (marqués en bleu) obtenus par microscopie à fluorescence. © Yonggang Lu/Université d’Osaka
Cette découverte pourrait ouvrir la voie à de nouvelles techniques de dépistage des maladies liées à la fertilité. Comprendre cette interaction moléculaire pourrait également potentiellement contribuer au développement de nouvelles interventions thérapeutiques contre l’infertilité. Les résultats de l’étude sont publiés dans la revue Cellule.
Vidéo de présentation de l’étude :