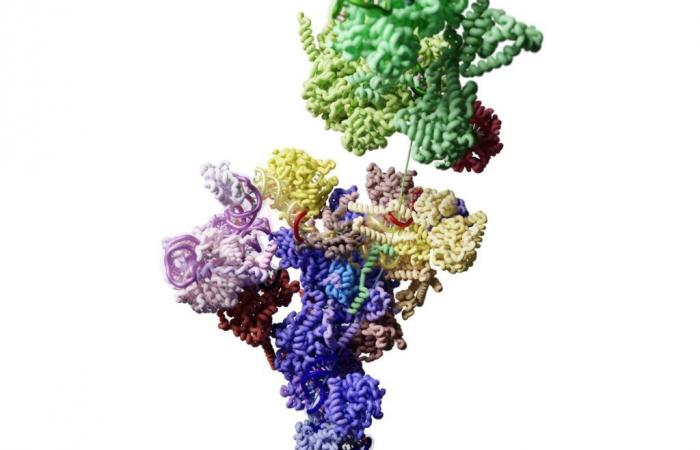
Le spliceosome. Sous ce nom abstrus se cache une machinerie cruciale au bon fonctionnement de nos cellules. Sa mission : participer au contrôle de l’activité de nos gènes – comme ceux de tous les organismes dits « eucaryotes », ces animaux, champignons, plantes ou levures composés de cellules dotées d’un noyau.
Dans le magazine Science à partir du 31 octobre, une équipe espagnole et américaine démonte les petits rouages de cette horloge biochimique. Les connaître, c’est aussi mieux comprendre un paradoxe : comment, au cours de l’évolution, les eucaryotes ont-ils pu devenir aussi complexes, alors même que le nombre de leurs gènes n’a guère augmenté ?
« Un petit ver nématode, Caenorhabditis eleganspossède 19 000 gènes, alors que notre espèce en possède à peine plus »souligne Clément Charenton, chercheur à l’Institut de génétique et de biologie moléculaire et cellulaire (CNRS), à Strasbourg. Nous disposons donc de 22 000 gènes codant pour des protéines ; Or, nos cellules peuvent produire plus de 200 000 protéines différentes.
Lire aussi (2022) | Article réservé à nos abonnés Le séquençage du génome humain touche (presque) à sa fin
Lire plus tard
Par quel stratagème ? Ici, nous devons revenir à une leçon fondamentale des cours de sciences de la vie et de la terre : comment les protéines de nos cellules sont-elles produites ? Lors d’une première étape, la séquence d’ADN d’un gène est « transcrite » en une molécule d’ARN dite « pré-messager », sorte de copie de cette séquence d’ADN. Ensuite, des protéines se forment par la traduction du message écrit dans cet ARN, grâce à un code génétique.
Épissage alternatif
C’est entre ces deux étapes qu’opère le spliceosome. L’une des clés du problème se cache dans la structure des gènes : ceux-ci sont, le plus souvent, des successions de séquences d’ADN dites « codantes », d’exons et de soi-disant séquences. « non codant », les introns. Et la molécule d’ARN pré-messager est complémentaire des exons et des introns.
Mais alors un phénomène étrange se produit : les séquences d’ARN correspondant aux introns sont découpées et supprimées. Seules les séquences d’ARN correspondant aux exons, après avoir été réunies, donneront l’ARN messager, qui sera traduit en protéines. Ce processus est appelé « épissage ». Sa découverte en 1977 vaut le prix Nobel de physiologie ou médecine au Britannique Richard Roberts et à l’Américain Phillip Sharp en 1993.
Au cours de l’évolution, un processus encore plus subtil, l’épissage alternatif, a été retenu par la sélection naturelle. C’est la possibilité, pour un ARN pré-messager d’un gène donné, de subir différents épissages, conduisant à des protéines différentes.
Il vous reste 63,51% de cet article à lire. Le reste est réservé aux abonnés.